காலியம்(III) குளோரைடு
காலியம்(III) குளோரைடு (Gallium(III) chloride) என்பது GaCl3 என்ற மூலக்கூற்று வாய்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். GaCl3·H2O என்ற ஒற்றைநீரேற்றாக உருவாகிறது. திண்ம காலியம்(III) குளோரைடு நீருறிஞ்சும் ஒரு வெள்ளை திடப்பொருளாகும். Ga2Cl6 என்ற வாய்ப்பாட்டுடன் இது இருமராக உள்ளது.[1] காலியம்(III) குளோரைடு நிறமற்றதாகும். கிட்டத்தட்ட அனைத்து கரைப்பான்களிலும் கரையும். உலோக ஆலைடுகளில் இப்பண்பு அசாதாரணமானதாகும். காலியத்தின் பெரும்பாலான வழிப்பெறுதிகளுக்கு முக்கிய முன்னோடிச் சேர்மமாகவும் கரிமத் தொகுப்பு வினைகளில் ஒரு வினையாக்கியாகவும் இச்சேர்மம் செயல்படுகிறது.[2]
| |

| |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
காலியம் முக்குளோரைடு, முக்குளோரோகாலியம், முக்குளோரோகாலேன்
| |
| இனங்காட்டிகள் | |
| 13450-90-3 | |
| ChemSpider | 24229 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 26010 |
| வே.ந.வி.ப எண் | LW9100000 |
| UNII | 4Y6GQD4915 |
| பண்புகள் | |
| GaCl 3 | |
| வாய்ப்பாட்டு எடை | 176.073 கி/மோல் (நீரிலி) 194.10 கி/மோல் (ஒற்றை நீரேற்று) |
| அடர்த்தி | 2.47 கி/செ.மீ3 (நீரிலி) |
| உருகுநிலை | 77.9 °C (172.2 °F; 351.0 K) (நீரிலி) 44.4 °செல்சியசு (ஒற்றை நீரேற்று) |
| கொதிநிலை | 201 °C (394 °F; 474 K) (நீரிலி) |
| கரையும் | |
| கரைதிறன் | பென்சீன், CCl4, CS2, மற்றும் ஆல்க்கேன் ஆகியவற்றில் கரையும். |
| −63.0·10−6 செ.மீ3/மோல் | |
| கட்டமைப்பு | |
| படிக அமைப்பு | ஒற்றைச் சரிவச்சு |
| புறவெளித் தொகுதி | C2/m |
| Lattice constant | a = 11.95 Å, b = 6.86 Å, c = 7.05 Å |
படிகக்கூடு மாறிலி
|
|
| தீங்குகள் | |
| GHS pictograms | 
|
| GHS signal word | அபாயம் |
| H314 | |
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றாது |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
4700 மி.கி/கி.கி (எலி, வாய்வழி) |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | காலியம்(III) புளோரைடு காலியம்(III) புரோமைடு காலியம்(III) அயோடைடு |
| ஏனைய நேர் மின்அயனிகள் | அலுமினியம் குளோரைடு இண்டியம்(III) குளோரைடு தாலியம்(III) குளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
இலூயிசு அமிலமாக, GaCl3 அலுமினியம் குளோரைடை விட வலிமை குறைந்த அமிலமாகும். அலுமினியம் குளோரைடை விடவும் குறைப்பதற்கும் எளிதானதாகும். Ga(III) மற்றும் Fe(III) ஆகியவற்றின் ஒருங்கிணைப்பு வேதியியல் ஒத்ததாக உள்ளது. எனவே காலியம்(III) குளோரைடு பெரிக் குளோரைடின் காந்த ஒப்புமையாகப் பயன்படுத்தப்படுகிறது.
தயாரிப்பு
தொகு200 °செல்சியசு வெப்பநிலையில் குளோரின் ஓட்டத்தில் காலியம் உலோகத்தை சூடாக்கி மூலத் தனிமங்களிலிருந்து காலியம்(III) குளோரைடு சேர்மத்தைத் தயாரிக்கலம். வெற்றிடத்தின் கீழ் பதங்கமாதல் முறையில் காலியம்(III) குளோரைடை சுத்திகரிக்கலாம்.[3][4]
- 2 Ga + 3 Cl2 → 2 GaCl3
காலியம் ஆக்சைடுடன் தயோனைல் குளோரைடைச் சேர்த்து சூடுபடுத்தியும் காலியம்(III) குளோரைடைத் தயாரிக்கலாம்.[5]
- Ga2O3 + 3 SOCl2 → 2 GaCl3 + 3 SO2
காலியம் உலோகம் ஐதரோகுளோரிக் அமிலத்துடன் மெதுவாக வினைபுரிந்து ஐதரசன் வாயுவை உருவாக்குகிறது.[6] இந்தக் கரைசலை ஆவியாக்கினால் காலியம் முக்குளோரைடின் ஒற்றைநீரேற்று உருவாகும்.[7]
கட்டமைப்பு
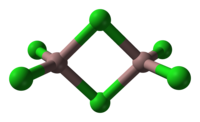
தொகுஒரு திடப்பொருளாக, காலியம்(III) குளோரைடு இரண்டு பாலம் அமைக்கும் குளோரைடுகளுடன் ஒரு இருநான்முகி கட்டமைப்பை ஏற்றுக்கொள்கிறது. இதன் அமைப்பு அலுமினியம் முப்புரோமைடை ஒத்திருக்கிறது. மாறாக AlCl3 மற்றும் InCl3 சேர்மங்களின் கட்டமைப்பில் 6 உலோக மையங்கள் உள்ளன. இதன் மூலக்கூறு தன்மை மற்றும் இதனுடன் தொடர்புடைய குறைந்த அணிக்கோவை ஆற்றலின் விளைவாக, காலியம்(III) குளோரைடு அலுமினியம் மற்றும் இண்டியம் முக்குளோரைடுகளுக்கு கு எதிராக குறைந்த உருகுநிலையைக் கொண்டுள்ளது. Ga2Cl6 இன் வாய்ப்பாடு ம் பெரும்பாலும் Ga2(μ-Cl)2Cl4 என எழுதப்படுகிறது.[8]
வாயு-கட்டத்தில், இருபடி (Ga2Cl6) மற்றும் முக்கோணத் தள ஒருபடி (GaCl3) ஆகியவை வெப்பநிலை சார்ந்த சமநிலையில் உள்ளன. அதிக வெப்பநிலை ஒருபடி வடிவத்திற்கு சாதகமாக இருக்கும். 870 கெல்வின் வெப்பநிலையில் அனைத்து வாயு-நிலை மூலக்கூறுகளும் திறம்பட ஒருபடி வடிவத்தில் உள்ளன.[9]
ஒற்றைநீரேற்றில் காலியம் மூன்று குளோரின் மூலக்கூறுகள் மற்றும் ஒரு நீர் மூலக்கூறுடன் நான்முகி வடிவில் ஒருங்கிணைக்கப்படுகிறது.[7]
பண்புகள்
தொகுஇயற்பியல் பண்புகள்
தொகுகாலியம்(III) குளோரைடு 77.9 பாகை செல்சியசு வெப்பநிலையில் உருகும். 201 பாகை செல்சியசு வெப்பநிலையில் தனிமங்கள் சிதைவடையாமல் கொதிக்கும். இந்த குறைந்த உருகுநிலையானது திட நிலையில் தனித்தனி Ga2Cl6 மூலக்கூறுகள் உருவாவதால் ஏற்படுகிறது. காலியம்(III) குளோரைடு வெப்ப வெளியீட்டால் தண்ணீரில் கரைந்து நிறமற்ற கரைசலை உருவாக்குகிறது. இக்கரைசல் ஆவியாகும்போது நிறமற்ற ஒற்றைநீரேற்றை உருவாக்குகிறது, இது 44.4 °செல்சியசு வெப்பநிலையில் உருகும்.[7][10][11]
வேதியியல் பண்புகள்
தொகுகுழு 13 இல் காலியம் ஒரு டி கூடு முழுவதும் நிரம்பிய இலகுவான உறுப்பினர் ஆகும். காலியத்தின் மின்னணு கட்டமைப்பு [Ar] 3d10 4s2 4p1 என்பதாக உள்ளது. இணைதிறம் எலக்ட்ரான்களுக்குக் கீழே இச்சேர்மம் ஈந்தணைவிகளுடன் d-π பிணைப்பில் பங்கேற்கிறது. Ga(III)Cl3 சேர்மத்தில் உள்ள காலியத்தின் குறைந்த ஆக்சிசனேற்ற நிலை, குறைந்த மின்னெதிர்த்தன்மை மற்றும் உயர் முனைப்புத் தன்மை ஆகியவற்றுடன், GaCl3 ஆனது கடினமான மற்றும் மென்மையான (இலூயிசு) அமிலங்கள் மற்றும் காரங்கள் கோட்பாட்டின் அடிப்படையில்[12] ஒரு மென்மையான அமிலமாகச் செயல்பட அனுமதிக்கிறது. காலியம் ஆலைடுகள் மற்றும் ஈந்தணைவிகளுக்கு இடையிலான பிணைப்புகளின் வலிமை விரிவாக ஆய்வு செய்யப்பட்டுள்ளது. வெளிப்படுவது என்னவென்றால்:[13]
- N மற்றும் O நன்கொடையாளர்களுடன் GaCl3 என்பது AlCl3 சேர்மத்தை விட பலவீனமானதாகும். எ.கா: பிரிடீன்
- தயோ ஈதர்களுடன் GaCl3 என்பது AlCl3 சேர்மத்தை விட வலுவான இலூயிசு அமிலம் ஆகும். எ.கா: டைமெத்தில் சல்பைடு, Me2S
ஒரு குளோரைடு அயனியை ஈந்தணைவியாகக் கொண்டு நான்முகி GaCl4− அயனி உற்பத்தி செய்யப்படுகிறது. 6 ஒருங்கிணைப்பு GaCl63- அயனியை உருவாக்க முடியாது. KGa2Cl7 போன்ற சேர்மங்கள் குளோரைடு பாலம் அமைக்கும் அயனியைக் கொண்டிருக்கின்றன.[14] KCl மற்றும் GaCl3 ஆகியவற்றின் உருகிய கலவையில், பின்வரும் சமநிலை உள்ளது:
- 2 GaCl4− Ga2Cl7− + Cl−
நீரில் கரைக்கப்படும் போது, அறுநீரியகாலியம்(III) அயனி நீராற்பகுப்பு காரணமாக, எண்முக காலியம்(III) குளோரைடு [Ga(H2O)6]3+ மற்றும் Cl- அயனிகளாகப் பிரிந்து அமிலக் கரைசலை உருவாக்குகிறது.
- [Ga(H2O)6]3+ → [Ga(H2O)5OH]2+ + H+ (pKa = 3.0)
காரக் கரைசலில், இது காலியம்(III) ஐதராக்சைடாக நீராற்பகுப்பு செய்யப்படுகிறது. அதிக ஐதராக்சைடைச் சேர்ப்பதன் மூலம் மீண்டும் கரைகிறது. இதனால் Ga(OH)4- அயனியை உருவாக்கும்.[15]
பயன்கள்
தொகுகரிமத் தொகுப்பு வினைகள்
தொகுகாலியம்(III) குளோரைடு பிரீடல்-கிராஃப்ட்சு வினை போன்ற ஓர் இலூயிசு அமில வினையூக்கியாகும். பெரிக் குளோரைடு போன்ற பொதுவான இலூயிசு அமிலங்களை மாற்றும் திறன் கொண்டதாக உள்ளது. π-நன்கொடையாளர்களுடன் வலுவாக காலியம் அணைவுகள், குறிப்பாக சிலில் ஈத்தைன்கள் வலுவான எலக்ட்ரான் நாட்ட அணைவை உருவாக்குகின்றன. இந்த அணைவுகள் அரோமாட்டிக் ஐதரோகார்பன்களுக்கு ஆல்கைலேற்ற முகவர்களாகப் பயன்படுத்தப்படுகின்றன.[2]
கார்பன்-கார்பன் முப்பிணைப்பு கொண்ட சேர்மங்களின் கார்போகாலேற்ற வினைகளிலும் இது பயன்படுத்தப்படுகிறது. பல கரிம வினைகளில் வினையூக்கியாகவும் பயன்படுத்தப்படுகிறது.[2]
கரிம காலியம் சேர்மங்கள்
தொகுகரிமகாலியம் வினைகளுக்கு காலியம்(III) குளோரைடு ஒரு முன்னோடியாகும். எடுத்துக்காட்டாக, மும்மெத்தில் காலியம் பல்வேறு காலியம் கொண்ட குறைக்கடத்திகளை உற்பத்தி செய்ய ஆவி-கட்டப் புறவளர்ச்சியில் பயன்படுத்தப்படுகிறது. காலியம்(III) குளோரைடுடன் இருமெத்தில்துத்தநாகம், மும்மெத்தில் அலுமினியம் அல்லது மெத்தில்மெக்னீசியம் அயோடைடு போன்ற பல்வேறு ஆல்கைலேற்றும் முகவர்கள் வினைபுரிவதால் மும்மெத்தில் காலியம் தயாரிக்கப்படுகிறது.[16][17][18]
காலியம் தூய்மையாக்கல்
தொகுகாலியம்(III) குளோரைடு பல்வேறு காலியம் சுத்திகரிப்பு செயல்முறைகளில் ஓர் இடைநிலை ஆகும், இதில் காலியம்(III) குளோரைடு பகுதியளவில் காய்ச்சி அல்லது அமிலக் கரைசல்களில் இருந்து பிரித்தெடுக்கப்படுகிறது.[6]
சோலார் நியூட்ரினோக்களைக் கண்டறிதல்
தொகு110 டன் காலியம்(III) குளோரைடு நீரிய கரைசல் நியூட்ரினோவை அறியும் கதிரியக்க வேதியியல் காலியம் சோதனைகளில் பயன்படுத்தப்படுகிறது. இப்பரிசோதனைகள் இத்தாலி நாட்டின் ஆய்வகங்களிலும் காலியம் நியூட்ரினோ ஆய்வகத்திலும் மேற்கொள்ளப்படுகின்றன. இந்த சோதனைகளில், காலியம்-71 உடன் நியூட்ரினோ தொடர்புகளால் செருமேனியம்-71 ஐசோடோப்பு தயாரிக்கப்பட்டது (இது இயற்கையில் மிகுதியாக 40% உள்ளது). மேலும் செருமேனியம்-71 இன் அடுத்தடுத்த பீட்டா சிதைவுகள் அளவிடப்பட்டன.[10]
மேற்கோள்கள்
தொகு- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. பன்னாட்டுத் தரப்புத்தக எண் 0-19-855370-6.
- ↑ 2.0 2.1 2.2 Yamaguchi, Masahiko; Matsunaga, Shigeki; Shibasaki, Masakatsu; Michelet, Bastien; Bour, Christophe; Gandon, Vincent (2014), "Gallium Trichloride", Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, Ltd, pp. 1–8, எண்ணிம ஆவணச் சுட்டி:10.1002/047084289x.rn00118u.pub3, பன்னாட்டுத் தரப்புத்தக எண் 9780470842898
- ↑ Roger A. Kovar; J. A. Dilts (1977). "Gallium Trichloride". Inorganic Syntheses Volume 17 (in ஆங்கிலம்). McGraw‐Hill. pp. 167–172. பன்னாட்டுத் தரப்புத்தக எண் 9780470131794.
- ↑ Gray, Floyd (2013). "Gallium and Gallium Compounds". Kirk-Othmer Encyclopedia of Chemical Technology. DOI:10.1002/0471238961.0701121219010215.a01.pub3. பன்னாட்டுத் தரப்புத்தக எண் 9780471238966.
- ↑ H. Hecht; G. Jander; H. Schlapmann (1947). "Über die Einwirkung von Thionylchlorid auf Oxyde" (in en). Zeitschrift für anorganische Chemie 254 (5-6): 255-264. doi:10.1002/zaac.19472540501.
- ↑ 6.0 6.1 Greber, Jörg (2000). "Gallium and Gallium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. DOI:10.1002/14356007.a12_163. பன்னாட்டுத் தரப்புத்தக எண் 9783527306732.
- ↑ 7.0 7.1 7.2 Jacques Roziere; Marie-Thérèse Roziere-Bories; Alain Manteghetti; Antoine Potier (1974). "Hydrates des halogenures de gallium. II Spectroscopie de vibration des complexes coordinés GaX3•H2O (X = Cl ou Br)" (in fr). Canadian Journal of Chemistry 52 (18): 3274-3280. doi:10.1139/v74-483. https://archive.org/details/sim_canadian-journal-of-chemistry_1974-09-15_52_18/page/n129.
- ↑ Sergey I. Troyanov; Thoralf Krahl; Erhard Kemnitz (2004). "Crystal structures of GaX3 (X = Cl, Br, I) and AlI3" (in en). Zeitschrift für Kristallographie - Crystalline Materials 219 (2): 88-92. doi:10.1524/zkri.219.2.88.26320.
- ↑ Viacheslav I. Tsirelnikov; Boris V. Lokshin; Petr Melnikov; Valter A. Nascimento (2012). "On the Existence of the Trimer of Gallium Trichloride in the Gaseous Phase" (in en). Zeitschrift für anorganische und allgemeine Chemie 638 (14): 2335-2339. doi:10.1002/zaac.201200282.
- ↑ 10.0 10.1 David R. Lide, ed. Handbook of Chemistry and Physics, 85th Edition, Internet Version 2005. CRC Press, 2005.
- ↑ J. Burgess; J. Kijowski (1981). "Enthalpies of solution of chlorides and iodides of gallium(III), indium(III), thorium(IV) and uranium(IV)" (in en). Journal of Inorganic and Nuclear Chemistry 43 (11): 2649-2652. doi:10.1016/0022-1902(81)80592-1.
- ↑ Housecroft, Catherine E.; Sharpe, Alan G. (2018) [2001]. Inorganic Chemistry (5th ed.). Harlow, Essex: Pearson Education. பன்னாட்டுத் தரப்புத்தக எண் 978-1-292-13414-7.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. pp. 237–239. பன்னாட்டுத் தரப்புத்தக எண் 0080379419.
- ↑ Jens H. Von Barner (1985). "Potentiometric and Raman spectroscopic study of the complex formation of gallium(III) in potassium chloride-aluminum chloride melts at 300C" (in en). Inorganic Chemistry 24 (11): 1686–1689. doi:10.1021/ic00205a019.
- ↑ Scott A. Wood; Iain M. Samson (2006). "The aqueous geochemistry of gallium, germanium, indium and scandium" (in en). Ore Geology Reviews 28 (1): 57-102. doi:10.1016/j.oregeorev.2003.06.002.
- ↑ Kraus, C. A.; Toonder, F. E. (1933). "Trimethyl Gallium, Trimethyl Gallium Etherate and Trimethyl Gallium Ammine". PNAS 19 (3): 292–8. doi:10.1073/pnas.19.3.292. பப்மெட்:16577510. Bibcode: 1933PNAS...19..292K.
- ↑ Foster, Douglas F.; Cole-Hamilton, David J. (1997). "Electronic Grade Alkyls of Group 12 and 13 Elements". Inorganic Syntheses. Vol. 31. p. 29-66. எண்ணிம ஆவணச் சுட்டி:10.1002/9780470132623.ch7. பன்னாட்டுத் தரப்புத்தக எண் 978-0-471-15288-0.
- ↑ WO application 2014078263, Liam P. Spencer, James C. Stevens, Deodatta Vinayak Shenai-Khatkhate, "Methods of producing trimethylgallium", published 2014-05-22
மேலும் வாசிக்க
தொகு- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. பன்னாட்டுத் தரப்புத்தக எண் 0080379419.
வெளி இணைப்புகள்
தொகு- "Emergency First Aid Treatment Guide - Gallium Trichloride". United States Environmental Protection Agency. Archived from the original on 2004-11-12.